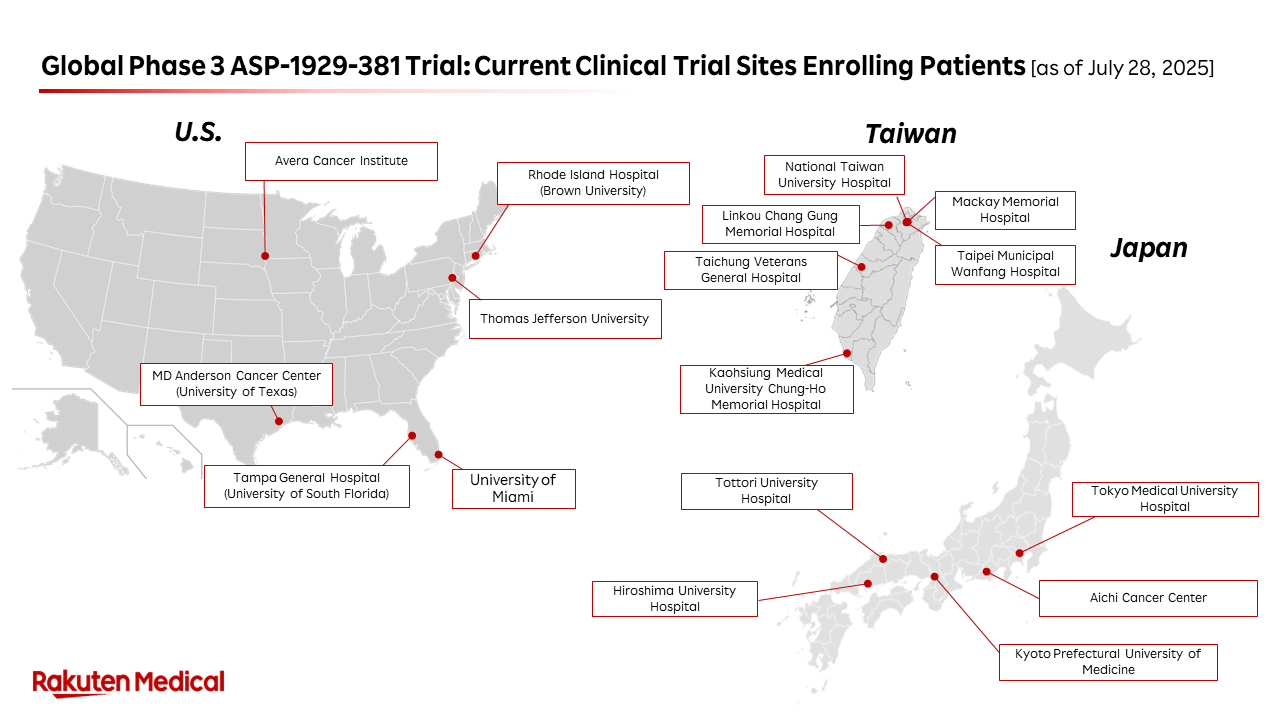
- 在美國、台灣和日本有超過 15 個臨床據點正積極招募病患
- 計劃將研究據點擴展至東歐,在烏克蘭和波蘭增設臨床試驗據點
全球生物技術公司樂天醫藥股份有限公司(Rakuten Medical, Inc.,以下簡稱「樂天醫藥」),致力於開發並商業化基於 Alluminox™ 平台的光免疫療法,今日宣布,其正在進行的全球第三期臨床試驗ASP-1929-381 將擴大臨床試驗據點,啟動日本的患者招募。該試驗旨在評估 ASP-1929 光免疫療法與 pembrolizumab 聯用,作為復發性頭頸鱗狀細胞癌 (HNSCC) 患者第一線治療的療效及安全性(試驗編號:ASP-1929-381,簡稱:ECLIPSE,ClinicalTrials.gov 註冊號:NCT06699212)。
目前,美國、台灣和日本有超過 15 家醫院正積極招募病患,預計這些地區還將開設更多的臨床試驗據點。為了進一步加速招募,樂天醫藥也計劃將研究擴展至東歐,近期將在烏克蘭和波蘭啟動新的研究據點。
樂天醫藥副董事長暨執行長 三木谷浩史表示:「我們的全球第三期研究在美國、台灣和日本正取得穩健的進展。為了進一步加速招募,我們正在擴大這些地區的研究據點,並準備在烏克蘭和波蘭開展新的研究地點。我們的設備方便攜帶,成本效益高,以便醫院廣泛採用。我們相信,我們的療法能為社會做出有意義的貢獻,包括那些醫療體系尚未發展完整和腫瘤醫療需求未被滿足的地域」
ASP-1929-381研究是一項多中心、隨機、開放標籤的第三期臨床試驗,旨在評估ASP-1929光免疫療法結合pembrolizumab作為無遠端轉移的局部復發性HNSCC第一線治療的療效和安全性。全球計劃招募412名患者,隨機分配至實驗組將接受ASP-1929光免疫療法聯合pembrolizumab,對照組則接受含有pembrolizumab的現行標準治療(SOC)。在對照組中,患者可根據醫師的判斷選擇單獨使用pembrolizumab或聯合化學治療進行治療。
主要研究指標為整體存活率(OS),關鍵次要研究指標包括完全反應率(CRR)和整體反應率(ORR)。
該研究基於一項早期階段研究的中期數據(ASP-1929-181 ClinicalTrials.gov註冊號:NCT04305795,數據截止日期:2023年8月31日),該研究HNSCC組中招募了19名患者。數據顯示,24個月的預期存活率為52.4%,中位整體存活率尚未達到,且整體安全性概況具有良好的耐受性。
關於樂天醫藥
樂天醫藥(Rakuten Medical Inc.)是一家全球性生物技術公司,致力於開發與商業化其專有 Alluminox™ 平台為基礎的光免疫療法。在臨床前研究中,顯示這個平台能誘發快速及選擇性的扼殺細胞與腫瘤壞死。除日本外,樂天醫藥的光免疫療法目前仍屬研發中,尚未獲得其他國家或地區的正式核准。樂天醫藥秉持「CONQUER CANCER(戰勝癌症)」的使命,致力於將其開創性療法儘速推廣至全球更多患者。公司總部位於美國,並於日本、台灣、瑞士及印度設有辦公據點,共橫跨五個國家/地區。關於更多資訊請造訪 https://rakuten-med.com/tw/。
關於Alluminox™ 平台
Alluminox™ 平台是一個試驗平台,以名為光免疫療法 (photoimmunotherapy) 的癌症療法作為基礎;光免疫療法是由美國國家癌症研究所 (National Cancer Institute) 的小林久隆博士與團隊共同開發。樂天醫藥目前正在發展 Alluminox 平台,以成為由藥物、醫療器材和其他相關組成部分所構成的技術。平台的藥物部分是由一個標靶分子與一個或多個染劑接合所構成,進而達到選擇性細胞表面受體結合的結果。醫療器材部分是由一個光源所構成,會發散光線局部照射目標細胞,以瞬間活化藥物。 根據臨床前的資料,顯示這個活化作用能透過生物物理過程破壞目標細胞的細胞膜完整性,進而引起目標細胞的快速及選擇性壞死。在 Alluminox 平台上開發的療法也可能會因為目標細胞的免疫原性細胞死亡,以及/或消除微環境中的免疫抑制元素,而造成局部性及全身性的先天與後天免疫活化作用。Alluminox 尚未在日本以外地區獲得任何監管機構的安全性與有效性核准。
關於ASP-1929
ASP-1929 是樂天醫藥使用 Alluminox 平台開發產品線的第一個藥物,這個抗體染劑複合體是由抗體 cetuximab 及光活化染劑 IRDye® 700DX 所組成。ASP-1929 結合表皮生⾧因子受體(epidermal growth factor receptor,簡稱 EGFR),這個癌症抗原會表現在多種類型的實質固態瘤中,包括頭頸癌、皮膚癌、食道癌、肺癌、大腸癌與胰臟癌。ASP-1929 在與癌細胞結合後,就會由雷射裝置系統發射的紅光 (690 nm) 照射,進行局部活化。 根據臨床前資料,指出 Alluminox 技術能誘發生物理過程,並破壞目標細胞的細胞膜完整性,達到癌細胞死亡與腫瘤壞死的結果。ASP-1929 在 2020 年9 月獲得日本厚生勞動省的有條件早期核准。正透過進行單一治療,以及和其他藥物之聯合治療的臨床試驗,推動產品開發。ASP-1929 光免疫療法結合 pembrolizumab 目前正在全球 三 期臨床試驗中進行研究,以作為復發性頭頸部癌症的第一線療法。ASP-1929 與雷射裝置系統尚未在日本以外地區獲得任何監管機構的商業使用核准。
