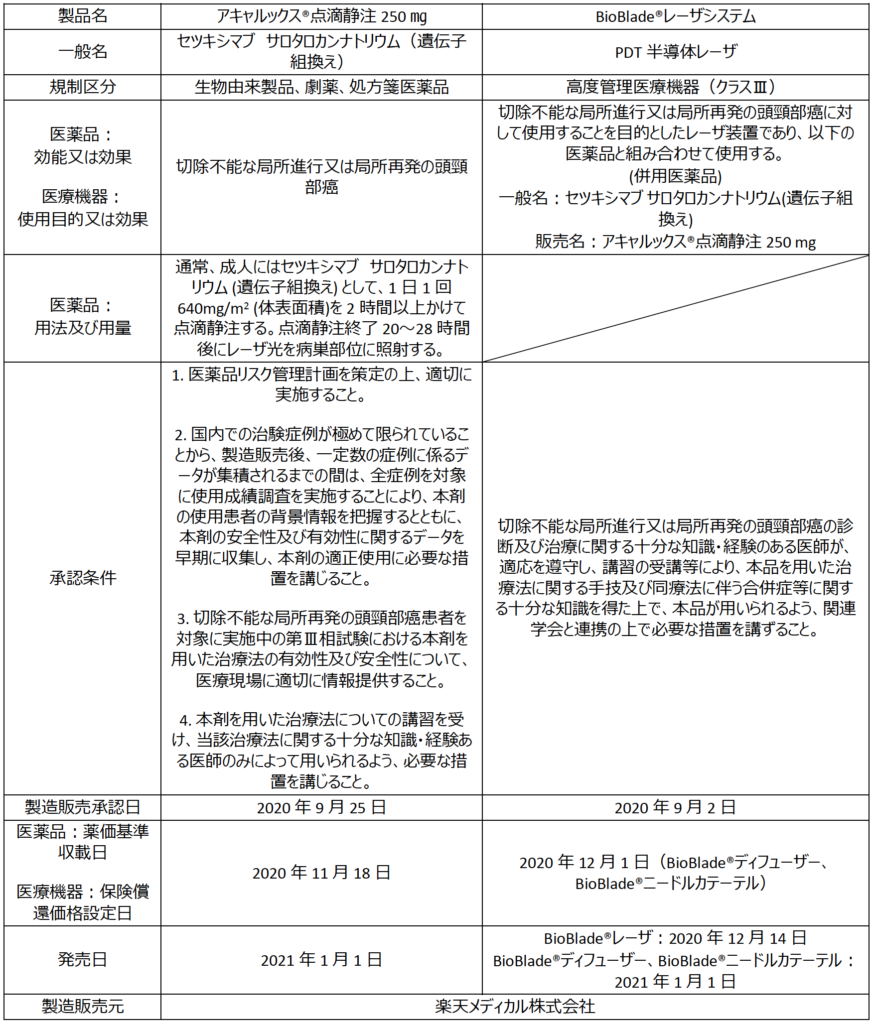
~32都道府県の165名の治療医によって治療が提供可能に~
楽天メディカル株式会社(本社:東京都世田谷区、代表取締役会長:三木谷 浩史)は、同社が製造販売を行う医薬品「アキャルックス®点滴静注250㎎」(一般名:セツキシマブ サロタロカンナトリウム(遺伝子組換え)/以下、本医薬品)および医療機器レーザ装置「BioBlade®レーザシステム」(以下、本医療機器)を用いた、頭頸部アルミノックス治療(光免疫療法)(以下、本治療)が提供可能な施設を拡大し、62施設(4月15日時点)となる予定であることをお知らせします。これにより、32都道府県で本治療が提供可能となります。
関連学会による後援・指導のもと当社が主催する講習プログラムを修了するなど、本治療の医師要件を満たした治療医は、165名(4月15日時点)となりました。当社は、今後も、一人でも多くの頭頸部がん患者さんに本治療をお届けできるよう、関連学会および治療医をはじめとする医療従事者の皆さまと緊密に連携してまいります。
【医療機関一覧1)】
本治療は、適正使用による安全性確保を目的として設定された施設要件を満たした医療機関において提供されます。クリニックや医院などの診療所で提供されている光免疫療法は、当社製品を用いた治療ではありません。現在、保険診療で受けられる本治療の適応症は「切除不能な局所進行又は局所再発の頭頸部がん」のみです。
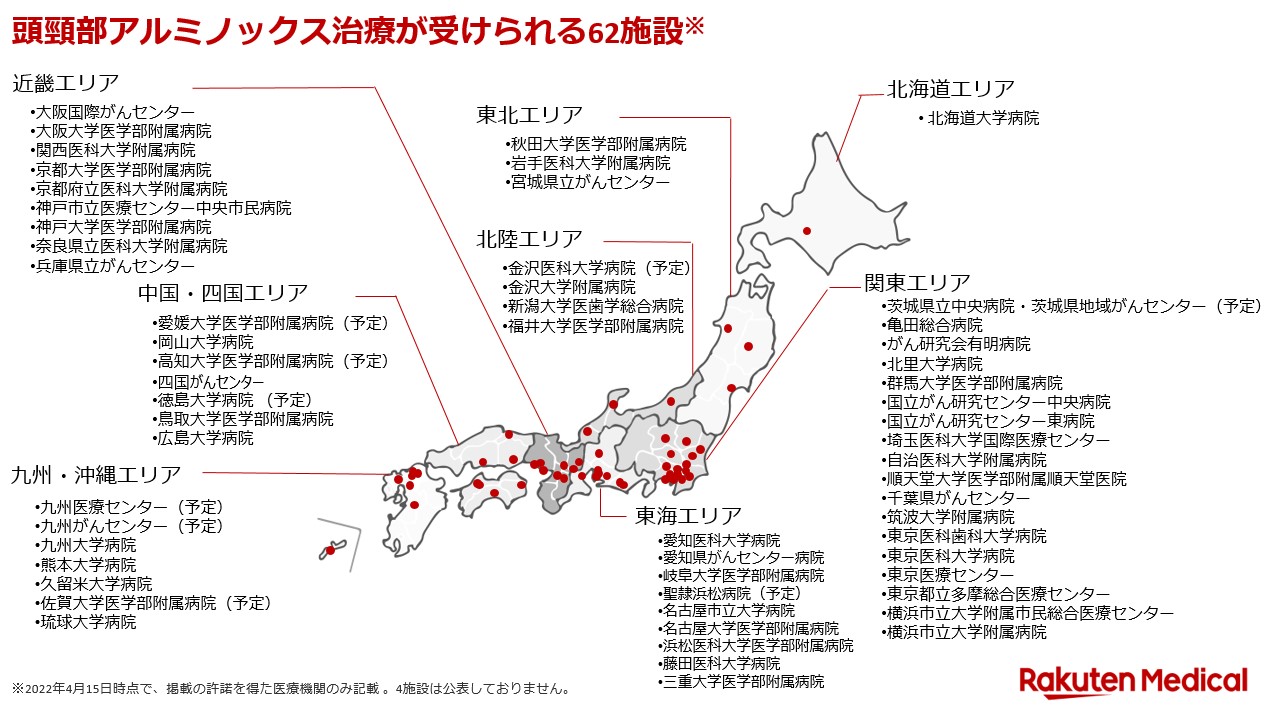
本医薬品および本医療機器の承認条件2)として、切除不能な局所進行又は局所再発の頭頸部癌の診断及び治療に関する十分な知識・経験のある医師が、治療法についての講習を受け、本治療に関する手技及び同療法に伴う合併症等に関する十分な知識を得た上で、本品が用いられるよう、関連学会と連携の上で必要な措置を講ずることが定められています。これを受け、当社は、本医薬品に係る「医薬品リスク管理計画書」3)において、「追加のリスク最小化活動」として使用条件(施設要件、医師要件および講習受講)を設けています。
1)本一覧は、2022年4月15日時点で掲載の許諾を得た医療機関のみ記載しております (各エリア五十音順)。新たに本治療の実施が可能となり、かつ、掲載許諾を得た医療機関については、順次お知らせする予定です。
2)承認条件の詳細は、以下の「製品概要」の「承認条件」の欄をご参照ください。
3)「医薬品リスク管理計画」(Risk Management Plan)は、個々の医薬品について安全性上の検討課題を特定し、使用成績調査、市販直後調査等による調査・情報収集や、医療関係者の皆様への追加の情報提供などの医薬品のリスクを低減するための取組みを、医薬品ごとに文書化したものです。
※患者さまおよびそのご家族におかれましては、必ず主治医を通して医療機関へお問い合わせいただきますようお願いいたします。なお、本治療の実施が可能かどうかは、各医療機関の医師の判断となります。
楽天メディカル株式会社について
楽天メディカル株式会社は、米国・カリフォルニア州サンディエゴに本社を構える楽天メディカル社の日本法人です。楽天メディカル社は、アルミノックス™プラットフォームと呼ぶ技術基盤を基に、薬剤と光を組み合わせた、がんをはじめとした様々な疾患に対する新しい治療法の開発を行うグローバルバイオテクノロジー企業です。同プラットフォームを基に開発された医薬品・医療機器の前臨床試験では、特定の細胞の速やか、かつ選択的な壊死をもたらすデータが示されています。楽天メディカル社は、世界中の一人でも多くの患者さんに、一日も早く、私たちの革新的な治療法をお届けすることにより「がん克服。」というミッションの実現を目指しています。米国に、本社と研究開発拠点を構え、日本、オランダ、台湾、スイスの世界5 カ国を拠点としています。詳しくは、https://rakuten-med.com/jp/をご覧ください。
頭頸部(とうけいぶ)がんについて
日本では、年間約28,000人*の方が頭頸部がんを発症しています。頭頸部がんとは、頭から鎖骨までの範囲に含まれるがんの総称です(脳と目は除く)。頭頸部は大きく分けて鼻、口腔、咽頭、喉頭といった器官で構成されており、発生部位により、咽頭がん(上咽頭がん、中咽頭がん、下咽頭がん)、喉頭がん(声門がん、声門上がん、声門下がん)、鼻腔・副鼻腔がん(上顎洞がんなど)、口腔がん(舌がんなど)、唾液腺がん、甲状腺がんなどの診断名がつきます。この頭頸部と呼ばれる部位には、呼吸や食事など人間が生きるうえで必要な機能、さらには発声、味覚、聴覚など日常生活に重要な機能が集中しています。これらに障害が起きるとQuality of Life (QOL: 生活の質)に影響を及ぼすため、がんを治すための根治性とQOLのバランスを保った治療法が必要とされています。
*政府統計の総合窓口e-Stat「全国がん登録罹患数・率」2018年調査(2-A)口腔、咽頭、喉頭がん合計値
アキャルックス®点滴静注250㎎について
アキャルックス®点滴静注250㎎は、キメラ型抗ヒト上皮成長因子受容体 (EGFR) モノクローナル抗体 (IgG1) であるセツキシマブと光感受物質である色素IRDye® 700DX を結合させた抗体薬物複合体からなる点滴静注用の注射剤です。アルミノックス® プラットフォームを基に開発された最初の医薬品で、一般名はセツキシマブ サロタロカンナトリウム (遺伝子組換え) です。
BioBlade®レーザシステムについて
BioBlade®レーザシステムは、アキャルックス®点滴静注250㎎と組み合わせて使用するレーザ装置です。レーザシステムは、BioBlade®レーザ、必要な付属品、ディフューザー及びニードルカテーテルにより構成されます。ディフューザーは、照射を行うための補助器具で、光ファイバーの前方から照射を行う表面照射用のフロンタルディフューザーと、光ファイバーの側面から照射を行う組織内照射用のシリンドリカルディフューザーの2種類があります。ニードルカテーテルは、組織内治療において、シリンドリカルディフューザーを導入するために使用します。
製品概要
<注意事項>
本文書に記載されている医薬品・医療機器に関する情報は、経営情報の開示を目的とするものであり、宣伝又は広告を目的とするものではありません。